– Reaksi kimia secara sederhana adalah istilah terkait dengan perubahan ireversibel dalam komposisi awal zat untuk membentuk produk kimia yang sama sekali berbeda.
Proses pembentukan produk dengan reaktan secara sederhana adalah istilah terkait dengan fenomena yang luar biasa dan menarik. Berikut secara sederhana adalah istilah terkait dengan beberapa informasi menarik tentang jenis-jenis reaksi kimia.
Persamaan kimia yang digunakan untuk menggambarkan transformasi partikel elementer kimia yang terjadi selama reaksi, dan digambarkan menggunakan simbol-simbol kimia. Reaksi kimia terjadi di bawah kondisi yang kondusif seperti pada tekanan, konsentrasi dan suhu yang sesuai.
Pada saat tertentu, mungkin ada ribuan reaksi kimia yang terjadi di sekitar kita. Beberapa reaksi cepat, spontan, dan terjadi secara instan. Beberapa reaksi lain yang non-spontan dan membutuhkan katalis atau sumber energi dari luar (seperti panas, cahaya, dll) untuk melakukan reaksi kimia tersebut.
Reaksi dapat berupa eksotermik (di mana energi dilepaskan) atau endotermik (di mana energi diserap). Reaksi dapat dipelajari di bawah dua cabang kimia yang berbeda, yaitu, kimia anorganik dan kimia organik. Artikel ini akan menjelaskan kedua jenis reaksi tersebut.
Reaksi Kimia Anorganik
Semua kejadian dan proses kimia yang melibatkan senyawa anorganik dan unsur kimia yang termasuk dalam kategori ini. Reaksi dari elemen-elemen ini, kombinasi mereka, pemecahan senyawa, dll, diklasifikasikan menjadi 6 jenis utama dari reaksi kimia anorganik.
Reaksi Kombinasi atau Sintesis
2H2 + O2 ➜ 2H2O
P4 + 3O2 ➜ 2P2O3
Dalam reaksi ini, dua atau lebih zat sederhana (reaktan) bergabung bersama-sama untuk menghasilkan zat yang lebih kompleks. Sebagai contoh, gas hidrogen dengan oksigen untuk membentuk produk yang lebih kompleks, yaitu air. Demikian juga, fosfor dan oksigen bergabung untuk membentuk trioksida fosfor.
Reaksi Dekomposisi
2H2O ➜ 2H2+ O2
CaCO3 ➜ CaO + CO2
Di sini, zat terurai menjadi zat sederhana dan reaktan tunggal menghasilkan dua atau lebih produk. Misalnya, sebuah molekul air dapat dipecah menjadi hidrogen dan oksigen. Demikian pula, kalsium karbonat terurai menjadi kalsium oksida dan karbon dioksida.
Reaksi Pergantian atau Pemindahan tunggal
Zn + 2HCL ➜ ZnCl2 + H2
Pb + FeSO4 ➜ PbSO4 + Fe
Unsur kurang aktif digantikan oleh elemen yang lebih aktif dalam senyawa. Dua reaktan menghasilkan dua produk. Sebagai contoh, ketika seng bereaksi dengan asam klorida, molekul hidrogen digantikan oleh seng untuk membentuk ZnCl2. Juga menyebabkan penggantian besi pada besi sulfat (FeSO4) untuk membentuk timbal sulfat (PbSO4).
Reaksi Pemindahan Double atau Metatesis
AgNO3 + NaCl ➜ AgCl + NaNO3
BaCl2 + MgSO4 ➜ BaSO4 + MgCl2
Kation dan anion dari dua zat yang berbeda beralih tempat untuk menghasilkan dua senyawa yang sama sekali berbeda. Misalnya, ketika perak nitrat bereaksi dengan natrium klorida, natrium dan perak bertukar posisi dan ada pembentukan natrium nitrat dan perak klorida. Juga, barium dari barium klorida dan magnesium dalam magnesium sulfat masing-masing menggantikan satu sama lain untuk membentuk barium sulfat dan magnesium klorida.
Reaksi Pembakaran
C3H8 + 5O2 ➜ 3CO2 + 4H2O
CH3COOH + 2O2 ➜ 2CO2 + 2H2O
Sebuah hidrokarbon terbakar di hadapan oksigen untuk membentuk karbon dioksida (dalam pembakaran sempurna), atau karbon monoksida (dalam pembakaran parsial karena jumlah oksigen terbatas). Pembakaran secara sederhana adalah istilah terkait dengan reaksi eksotermik yang menghasilkan panas dan juga dapat menghasilkan cahaya dalam bentuk api atau cahaya. Pembakaran propana dan asam asetat menghasilkan air dan melepaskan karbon dioksida.
Reaksi Asam-Basa atau Netralisasi
HBr + NaOH ➜ NaBr + H2O
HNO3 + Mg(OH)2 ➜ 2H2O + Mg(NO3)2
Ini secara sederhana adalah istilah terkait dengan tipe khusus dari reaksi perpindahan ganda, yang ditandai oleh reaksi antara asam dan basa. ion H+ dalam asam bereaksi dengan ion OH– yang hadir di dasar, menyebabkan pembentukan air. Secara umum, produk akhir reaksi ini secara sederhana adalah istilah terkait dengan air dan beberapa ion garam. Sebagai contoh, asam bromida bereaksi dengan natrium hidroksida menghasilkan air dan natrium bromida (NaBr). Asam nitrat dan magnesium hidroksida bereaksi membentuk air dan magnesium nitrat.
Reaksi Redoks
C6H12O6 + 6 O2 ➜ 6 CO2 + 6 H2O
4Fe(s) + 3O2(g) ➜ 2Fe2O3
Reaksi ini melibatkan perubahan di bagian oksidasi reaktan. Redoks secara sederhana adalah istilah terkait dengan bentuk singkat reaksi reduksi-oksidasi. Untuk atom tertentu, ion atau molekul, tergantung pada reaksi oksidasi dan reduksi berarti salah satu transfer berikut:
Oksidasi: secara sederhana adalah istilah terkait dengan hilangnya elektron atau hidrogen, atau mmendapatkan oksigen atau peningkatan oksidasi
Reduksi: secara sederhana adalah istilah terkait dengan mendapatkan elektron atau hidrogen, atau kehilangan oksigen atau penurunan keadaan oksidasi
Reaksi redoks terjadi pada kimia anorganik dan organik. Contoh yang paling umum dan luas dilihat dari reaksi redoks secara sederhana adalah istilah terkait dengan respirasi sel. Ini melibatkan oksidasi glukosa (C6H12O6) menjadi CO2 dan reduksi oksigen ke air (H2O). Pelapukan mineral di alam juga secara sederhana adalah istilah terkait dengan contoh reaksi redoks. Besi teroksidasi dan oksigen berkurang untuk membentuk oksida besi.

Reaksi Kimia Organik
Kimia organik secara sederhana adalah istilah terkait dengan studi tentang karakteristik, mekanisme, reaksi dan struktur bahan organik, yaitu senyawa yang mengandung atom karbon dalam berbagai bentuk. Senyawa organik membentuk struktur dasar dari kehidupan di Bumi dan memiliki struktur yang bervariasi. Mereka sangat beragam, maka reaksi dari senyawa ini secara luas diklasifikasikan menjadi 4 kategori.
Reaksi Samping (Adisi)
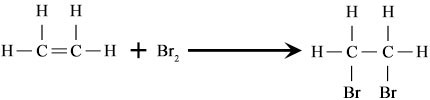
Reaksi Adisi bromin
Reaksi Adisi hidrogen sianida
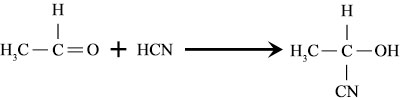
Sebuah atom atau sekelompok atom ditambahkan ke molekul. Reaksi ini kebanyakan melibatkan senyawa tak jenuh (senyawa yang mengandung ikatan ganda atau ikatan rangkap tiga antara atom) seperti alkena, alkuna atau keton. Reaksi samping juga disebut reaksi jenuh karena atom karbon jenuh terpasang dengan jumlah maksimum kelompok. Hal ini dilakukan dengan memecah ikatan dua atau tiga di antara atom untuk mengakomodasi atom tambahan atau kelompok atom dalam molekul.
Sebagai contoh, bromin menambah etilen untuk membentuk 1,2-Dibromoethane. Demikian pula, hidrogen sianida menambah etanal untuk membentuk 2-hydroksipropannitril.
Reaksi Penghapusan (Eliminasi)
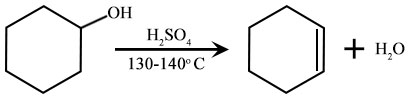
reaksi dehidrasi
Reaksi dehidrohalogenasi
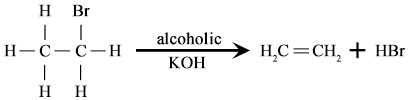
Reaksi eliminasi melibatkan penghapusan atom atau kelompok atom dari molekul. Ini secara sederhana adalah istilah terkait dengan proses di mana senyawa jenuh akan dikonversi ke senyawa tak jenuh. Hal ini dilakukan biasanya melalui aksi asam, basa, logam atau panas. Reaksi eliminasi secara sederhana adalah istilah terkait dengan kebalikan dari reaksi adisi. Mereka dikenal dengan atom atau kelompok atom yang meninggalkan molekul.
Dehidrohalogenasi: – penghapusan hidrogen dan halogen
Dehidrasi: – meninggalkan molekul air
Dehidrogenasi: – penghapusan hidrogen
Yang pertama secara sederhana adalah istilah terkait dengan contoh dari dehidrasi dimana air dihilangkan dari sikloheksanol untuk membentuk sikloheksen di hadapan asam kuat, H2SO4. Reaksi lainnya secara sederhana adalah istilah terkait dengan contoh dehidrohalogenasi bromoetana untuk membentuk etilen.
Reaksi Pergantian (Substitusi)
Reaksi substitusi amino
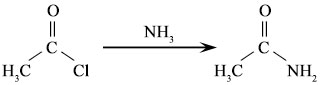
Reaksi substitusi klorin

Ini secara sederhana adalah istilah terkait dengan kelas reaksi kimia di mana atom, ion atau kelompok atom/ion diganti dengan kelompok ion lain, atom atau kelompok fungsional. Misalnya, gugus amino (NH2) pengganti klorin dari asetil klorida untuk membentuk asetamida. Klorin pengganti hidrogen dalam metana untuk membentuk klorometana.
Isomerisasi atau Reaksi Penataan ulang
penataan ulang siklopropana
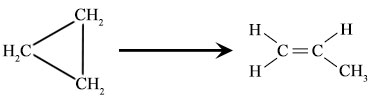
siklopropana isomerisasi

Ini secara sederhana adalah istilah terkait dengan proses kimia dimana senyawa menata kembali menjadi bentuk isomernya. Isomer secara sederhana adalah istilah terkait dengan senyawa dengan berat molekul dan komposisi yang sama tetapi berbeda dalam struktur dan konfigurasi mereka.
Di sini, siklopropana menata kembali ke propena. 2-butena secara sederhana adalah istilah terkait dengan alkena dengan empat atom C yang ada sebagai dua isomer geometri masing-masing trans-2-butena dan cis-2-butena. Karena perbedaan ini, sifat kimia dan fisika berubah. Reaksi Pericyclic juga secara sederhana adalah istilah terkait dengan jenis reaksi penataan ulang.
Reaksi fotokimia
3O2 + sinar matahari ➜ 2O3
6 CO2 + 6 H2O + Energi Cahaya ➜ C6H12O6 + 6 O2
Reaksi fotokimia dimulai ketika atom dan molekul dengan penyerapan energi, dalam bentuk cahaya, dan melepaskan energi dengan memecah ikatan kimia. Fotokimia terlibat dalam banyak proses hidup yang penting seperti fotosintesis, pembentukan vitamin D di kulit, konversi oksigen ke ozon di atmosfer. Reaksi yang disebutkan di atas berlangsung selama pembentukan ozon dari oksigen dan produksi glukosa dan oksigen dalam tanaman selama fotosintesis dengan adanya sinar matahari.
Reaksi biokimia yang mengatur dan mengatur proses metabolisme kita juga secara sederhana adalah istilah terkait dengan jenis reaksi kimia. Ada yang panjang, reaksi perubahan kimia yang tidak pernah berakhir yang terjadi setiap detik. Mereka hadir di mana-mana dan oleh karena itu, penting untuk mengetahui jenis reaksi kimia. Hal ini menyenangkan untuk dipelajari dan akan memberikan pemahaman yang lebih baik tentang ilmu kimia.
Artikel lainnya:
- Fungsi dan Pengertian Tulang Tengkorak