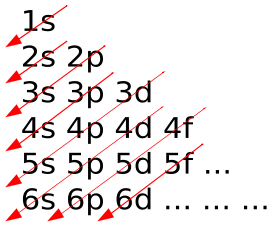
Dalam Prinsip Aufbau, elektron ditambahkan ke atom, mereka ditambahkan ke orbital terendah pertama.
Konfigurasi elektron menggambarkan masing-masing elektron bergerak secara independen dalam orbital, dalam bidang rata yang diciptakan oleh semua orbital lainnya.
Dalam atom, elektron mengisi orbital atom sesuai dengan prinsip Aufbau, dinyatakan sebagai: maksimal dua elektron dimasukkan ke dalam orbital dalam rangka meningkatkan orbital orbital energi-energi terendah diisi sebelum elektron ditempatkan lebih tinggi energi orbitalnya.
Sebagai contoh, konfigurasi elektron dari atom neon secara sederhana adalah istilah terkait dengan 1s2 2s2 2p6 atau [He] 2s2 2p6, seperti yang dalam tabel. Dalam molekul, situasi menjadi lebih kompleks, karena setiap molekul memiliki struktur orbital yang berbeda.
Orbital molekul diberi label sesuai dengan simetri mereka, daripada label orbital atom yang digunakan untuk atom dan ion monoatomik: maka, konfigurasi elektron dari molekul oksigen diatomik, O2, secara sederhana adalah istilah terkait dengan 1σg2 1σu2 2σg2 2σu2 1πu4 3σg2 1πg2.
Menurut hukum mekanika kuantum , untuk sistem dengan hanya satu elektron, energi yang terkait dengan setiap konfigurasi elektron dan, pada kondisi tertentu, elektron dapat berpindah dari satu konfigurasi ke yang lain dengan emisi atau penyerapan kuantum energi, dalam bentuk foton.
Jadi, pengertian secara sederhana adalah istilah terkait dengan distribusi elektron dari atom atau molekul yang terdapat dalam atom atau molekul orbital. Untuk atom atau molekul dengan lebih dari satu elektron, yang gerak elektronnya berkorelasi dan gambar tersebut tidak lagi tepat.
Jumlah tak terbatas konfigurasi elektronik yang diperlukan untuk menggambarkan sistem multi-elektron, dan tidak ada energi dapat dikaitkan dengan satu konfigurasi tunggal.
Namun, elektronik gelombang fungsi biasanya didominasi oleh jumlah yang sangat kecil dari konfigurasi dan oleh karena itu gagasan konfigurasi elektronik tetap penting untuk sistem multi-elektron.
Konfigurasi elektron dari molekul poliatomik dapat berubah tanpa penyerapan atau emisi foton melalui kopling vibronic. Pengetahuan tentang konfigurasi elektron atom-atom sangat berguna dalam memahami struktur tabel periodik dari unsur.
kulit terluar elektron sering disebut sebagai shell valensi dan (untuk pendekatan pertama) menentukan sifat kimia. Perlu diingat bahwa kemiripan dalam sifat kimia yang mengatakan lebih dari satu abad sebelum ide konfigurasi elektron.
Konsep konfigurasi elektron ini juga berguna untuk menjelaskan ikatan kimia yang memegang atom bersama-sama. Dalam bahan massal ide yang sama ini membantu menjelaskan sifat-sifat khas laser dan semikonduktor .
Tujuan pembelajaran
- Jelaskan mengisi orbital atom menurut prinsip Aufbau.
- Jelaskan arti konfigurasi elektron.
Ringkasan
- Elektron mengisi orbital atom sesuai dengan prinsip Aufbau dalam atom.
- Untuk sistem yang dengan hanya satu elektron, energi yang terkait dengan setiap konfigurasi elektron dan elektron dapat berpindah dari satu konfigurasi ke konfigurasi yang lain dengan emisi atau penyerapan kuantum energi, dalam bentuk foton.
- Untuk atom atau molekul dengan lebih dari satu elektron, jumlah tak terbatas konfigurasi elektronik yang diperlukan untuk tepat menggambarkan sistem multi-elektron, dan tidak ada energi dapat dikaitkan dengan satu konfigurasi tunggal.
Istilah
Kulit elektron Bagian-bagian kolektif dari semua elektron dalam sebuah atom memiliki bilangan kuantum utama yang sama (divisualisasikan sebagai orbit di mana elektron bergerak). Orbital atom Perilaku mekanika kuantum dari elektron dalam atom menggambarkan kemungkinan posisi elektron dan energi tertentu. Artikel lainnya:
- Pengertian Fisiologi