Perbedaan antara monoatomik dan diatomik terutama berkaitan dengan atom yang hadir dalam suatu unsur. Seperti namanya, kedua istilah ini berdiri untuk bagian yang berbeda dari asosiasi atom di mana ‘mono’ berarti ‘satu’ dan ‘di’ berarti ‘dua’. Oleh karena itu, ‘satu atom’ berarti monoatomik dan dua atom berarti ‘diatomik ‘. Namun, ada bisa begitu banyak variasi yang berbeda dengan definisi dasar ini.
Monoatomik
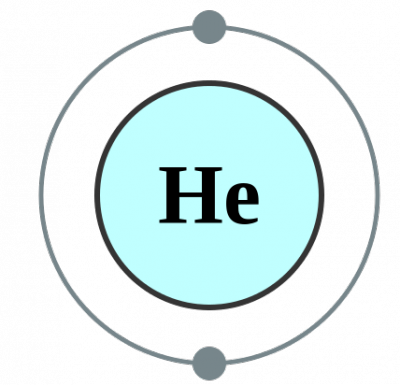
Ketika atom tunggal ada dengan sendirinya (yang jarang terjadi), kita menyebutnya monoatomik. Ini berarti unsur-unsur dalam bentuk murni mereka. Satu-satunya contoh praktis kategori monoatomik secara sederhana adalah istilah terkait dengan gas mulia yang ada sebagai atom tunggal karena mereka memiliki kulit luar mereka lengkap dengan oktet elektron. Oleh karena itu, mereka menerima atau menyumbangkan elektron agar lebih stabil. Oleh karena itu, gas mulia stabil dalam bentuk monoatomik. Beberapa contoh adalah; He – Helium, Ne – Neon, Ar – Argon, Xe – Xenon, Kr – Krypton, Rn – Radon.
Ada juga ada atom tunggal dalam bentuk ion terutama dalam larutan, dan beberapa contohnya adalah; Na+, Ca2+, K+ dll. Ion ini memiliki muatan tetap yang berarti bahwa mereka memiliki valensi yang konstan. Tapi, ada jenis lain dari ion yang memiliki banyak valensi dan bisa eksis dalam berbagai bentuk ionik, yang masih monoatomik.
Contohnya secara sederhana adalah istilah terkait dengan besi; Fe2+ dan Fe3+. Tidak hanya kation (ion bermuatan positif) tetapi anion (ion bermuatan negatif) juga ada dalam bentuk monoatomik; Cl–, F–, I– secara sederhana adalah istilah terkait dengan beberapa contoh. Ion ini tidak stabil dan secara alami akan mencari unsur lain untuk membentuk senyawa. Tapi, seperti yang disebutkan di atas, mereka dapat ditemukan dalam larutan atas hidrolisis senyawa mereka.
Senyawa ionik terbentuk karena kurangnya stabilitas atom tunggal dalam bentuk murni yang tidak dapat mencapai konfigurasi elektron gas mulia. Oleh karena itu, atom-atom ini menerima atau menyumbangkan elektron untuk mendapatkan stabilitas.
Diatomik
Ketika dua atom bergabung satu sama lain, kita menyebutnya diatomik. Atom-atom ini bisa dari jenis yang sama atau berbeda. Ketika mereka secara sederhana adalah istilah terkait dengan dua atom yang sama dalam suatu ikatan kita menyebutnya ‘diatom homonuklir’ dan jika mereka dibuat dari berbagai jenis kita menyebutnya ‘diatomheteronuklir’. Contoh untuk beberapa diatom homonuclear akan O2, N2, H2, dll sedangkan CO, NO, HCl, dll dapat diberikan sebagai contoh untuk diatom heteronuklir.
Diatom dapat dianggap sebagai senyawa karena mereka membentuk ikatan ini untuk mencapai stabilitas yang lebih dengan berbagi elektron antara satu sama lain sehingga kedua atom mencapai konfigurasi elektron gas mulia. Mereka dapat berikatan melalui ikatan kovalen dengan tumpang tindih orbital atom atau mereka dapat membentuk ikatan ionik antara mereka yang secara sederhana adalah istilah terkait dengan daya tarik kekuatan antara unsur bermuatan positif dan unsur bermuatan negatif.
Contoh untuk ikatan kovalen antara diatom termasuk CO, NO, dll dan HCl dapat dianggap sebagai unsur yang bersifat memiliki daya tarik ionik. Namun, sebagai ion yang daya tarik kekuatan antara H+ dan Cl– tidak terlalu kuat, ini bukanlah contoh dari ikatan ion yang didefinisikan.
Perbedaan antara monoatomik dan diatomik
- unsur monoatomik memiliki satu atom sedangkan unsur diatomik memiliki dua atom.
- unsur monoatomik umumnya tidak stabil, tetapi unsur diatomik umumnya stabil.
- Gas mulia hanya ditemukan dalam bentuk monoatomik dan tidak ditemukan dalam bentuk diatomik.
- Ikatan kimia terjadi di antara unsur diatomik sedangkan tidak ada ikatan kimia dalam unsur monoatomik.