Elektronegativitas secara sederhana adalah istilah terkait dengan sifat yang menggambarkan kecenderungan atom untuk menarik elektron (atau kerapatan elektron).
Elektronegativitas atom dipengaruhi oleh jumlah atom dan ukuran atom. Semakin tinggi elektronegativitas, unsur semakin menarik elektron. Kebalikan dari elektronegativitas secara sederhana adalah istilah terkait dengan elektropositivitas, yang secara sederhana adalah istilah terkait dengan ukuran kemampuan unsur untuk menyumbangkan elektron.
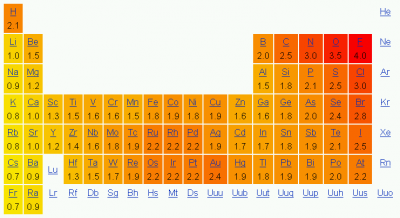
Elektronegativitas tidak langsung diukur, tetapi malah dihitung berdasarkan pengukuran eksperimental sifat atom atau molekul lainnya. Beberapa metode perhitungan telah diusulkan, dan meskipun mungkin ada perbedaan kecil dalam nilai numerik dari nilai-nilai elektronegativitas yang dihitung, semua metode menunjukkan tren periodik yang sama di antara unsur-unsur.
Elektronegativitas, biasanya dihitung, tidak sepenuhnya milik atom, melainkan milik sebuah atom dalam molekul. Sifat atom bebas meliputi energi ionisasi dan afinitas elektron. Diharapkan bahwa elektronegativitas dari unsur akan berbeda dengan lingkungan kimia, tetapi biasanya dianggap sebagai sifat dipindahtangankan; artinya, nilai-nilai yang sama akan berlaku dalam berbagai situasi.
Pada tingkat yang paling dasar, elektronegativitas ditentukan oleh faktor-faktor seperti muatan inti dan jumlah/lokasi elektron lain yang hadir dalam kulit terluar. Muatan inti penting karena semakin banyak atom proton, semakin “menarik” yang akan terjadi pada elektron negatif. Di mana elektron berada dalam ruang secara sederhana adalah istilah terkait dengan faktor karena memiliki elektron atom lebih, semakin jauh dari inti akan menjadi elektron valensi, dan sebagai akibatnya mereka akan mengalami muatan kurang positif; hal ini disebabkan meningkatnya jarak dari inti, dan karena elektron lain di orbital inti-energi yang lebih rendah akan bertindak untuk melindungi elektron valensi dari inti bermuatan positif.
Metode yang paling umum perhitungan ang digunakan untuk elektronegativitas diusulkan oleh Linus Pauling. Metode ini menghasilkan jumlah berdimensi, sering disebut sebagai skala Pauling, dengan kisaran dari 0,7 sampai 4. Jika kita melihat tabel periodik tanpa gas inert, elektronegativitas yang besar di kanan atas dan terendah di bagian kiri bawah.
Oleh karena itu, fluor (F) secara sederhana adalah istilah terkait dengan elektronegatif yang paling besar, sedangkan fransium (Fr) secara sederhana adalah istilah terkait dengan elektronegatif yang paling kecil dari unsur-unsur.
Bilangan Oksidasi
Bilangan Oksidasi umum untuk mempertimbangkan nilai tunggal elektronegativitas akan berlaku untuk kebanyakan ikatan atom. Meskipun pendekatan ini memiliki keuntungan dari kesederhanaan, jelas bahwa elektronegativitas dari suatu unsur secara sederhana adalah istilah terkait dengan tidak merubah siifat atom.; melainkan dapat dianggap tergantung pada besaran yang disebut ‘bilangan oksidasi’ dari unsur.
Salah satu cara untuk menggambarkan atom dalam molekul dan melacak elektron secara sederhana adalah istilah terkait dengan dengan menetapkan nomor oksidasi. Bilangan oksidasi secara sederhana adalah istilah terkait dengan muatan listrik atom akan memiliki jika elektron ikatan ditugaskan secara eksklusif pada atom yang lebih elektronegatif, dan dapat mengidentifikasi atom teroksidasi dan yang berkurang dalam proses kimia. Enam aturan dapat digunakan ketika menetapkan bilangan oksidasi:
- Bilangan oksidasi suatu unsur dalam keadaan aslinya (yaitu, yang ditemukan di alam) secara sederhana adalah istilah terkait dengan nol. Misalnya, hidrogen di H2, oksigen di O2, nitrogen di N2, karbon dalam berlian, dll, memiliki bilangan oksidasi nol.
- Dalam senyawa ion, muatan ion atom secara sederhana adalah istilah terkait dengan nomor oksidasi.
- Jumlah bilangan oksidasi semua atom dalam ion atau molekul sama dengan muatan bersih.
- Dalam senyawa yang terkait dengan non logam, bilangan oksidasi hidrogen secara sederhana adalah istilah terkait dengan +1. Namun, ketika hidrogen terikat dengan logam, bilangan oksidasinya menjadi -1 karena logam secara sederhana adalah istilah terkait dengan unsur yang lebih elektropositif, atau kurang elektronegatif.
- Bilangan oksidasi Oksigen secara sederhana adalah istilah terkait dengan -2 di sebagian besar senyawa. Namun, ada pengecualian tertentu. Dalam peroksida (O22-), seperti hidrogen peroksida (H2O2), bilangan oksidasi oksigen secara sederhana adalah istilah terkait dengan -1. Dalam oksigen difluorida (OF2), bilangan oksidasi oksigen +2, sedangkan di dioksigen difluorida (O2F2), bilangan oksidasi oksigen secara sederhana adalah istilah terkait dengan +1 karena fluor secara sederhana adalah istilah terkait dengan unsur yang lebih elektronegatif dalam senyawa ini, sehingga ditetapkan jumlah oksidasi secara sederhana adalah istilah terkait dengan -1.
- Atom dengan elektronegativitas lebih tinggi, biasanya unsur bukan logam, diberi nomor oksidasi negatif, sedangkan atom lainnya, yang sering tetapi belum tentu unsur logam, diberikan bilangan oksidasi positif.