– Isotop radioaktif digunakan sebagai pelacak untuk mendiagnosa berbagai penyakit, juga digunakan untuk mempelajari mekanisme reaksi-reaksi yang rumit seperti fotosintesis, hidrolisis ester, dll.
“Berbagai jenis atom dari unsur yang sama dan memiliki jumlah atom yang sama tetapi nomor massa atomnya berbeda (atau berat atom) unsur tersebut disebut isotop.”
Ketika isotop memiliki nomor atom yang sama, kita dapat mendefinisikan sebagai:
“Atom dari unsur yang sama dengan jumlah proton yang sama, namun nomor neutron berbeda dalam inti masing-masing.”
Ciri-ciri Isotop
Isotop dari setiap elemen akan memiliki jumlah elektron valensi yang sama atau valensi, sehingga sifat kimianya sama.
Sifat fisik isotop ‘berbeda terutama disebabkan oleh variasi jumlah neutron, yang hadir dalam nukleus. Sifat seperti titik leleh, titik didih, kerapatan dll, yang tergantung pada massa atom harus berbeda untuk isotop yang berbeda karena unsur isotop memiliki massa yang berbeda.
Cl – 35,5
Cu = 63,5
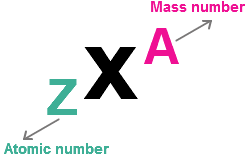
Massa Atom Isotop
Kita tahu bahwa atom terdiri dari neutron, proton dan elektron. Jumlah massa partikel pendukung dalam isotop tertentu dari suatu unsur disebut sebagai massa atom.
Massa atom isotop = Massa neutron + Massa elektron + Massa proton.
Karena massa elektron praktis nihil, di kisaran 0.0005449 Amu, massa atom elektron sama dengan jumlah massa dari neutron dan proton yang ada di dalamnya.
Massa atom isotop = Massa neutron + Massa proton
Juga, kita tahu bahwa jumlah massa isotop secara sederhana adalah istilah terkait dengan seluruh nomor. Sekarang, karena massa atom isotop dari elemen umumnya sejumlah pecahan, jumlah massa isotop yang harus bilangan bulat diperoleh dengan pembulatan nilai massa atom isotop ke seluruh nomor terdekat.
Sebagai contoh, dua isotop klorin memiliki massa atom sama dengan 34,980 dan 36,977, nomor massa masing-masing dibulatkan ke 35 dan 37.
Isotop radioaktif
- unsur-unsur Isotop seperti hidrogen, klorin, neon, oksigen, dll, ada di alam dan stabil. Tetapi beberapa elemen isotop radioaktif di alam tidak cukup stabil.
Contoh: Isotop yang radioaktif di alam disebut radioisotop. - Uranium memiliki dua isotop, U – 238 secara sederhana adalah istilah terkait dengan bentuk stabil Uranium.
- Ketika Uranium dibombardir dengan elektron lambat, U – 239 diperoleh.
- U – 239 secara sederhana adalah istilah terkait dengan radioisotop dengan masa hidup setengah dari 23 menit dan hancur memancarkan partikel beta untuk menghasilkan elemen baru, neptunium, dengan nomor massa 239 dan nomor atom 93.
- Dengan demikian, isotop Uranium memiliki siklus hidup yang sangat kecil dan sangat tidak stabil.
- Sebanyak 20 isotop neptunium yang terbentuk selama reaksi radioaktif dengan nomor massa berkisar 231-240.
- Demikian pula, Plutonium, Pu memiliki dua isotop, radioaktif.
- Mereka memiliki nomor massa Pu – 241 dan Pu – 239. Mereka berdua hancur untuk memberikan dua unsur penting trans uranium, amerisium, Am, dengan nomor massa 241 dan nomor atom 95 dan Curium, dengan nomor atom 96 dan nomor massa 239.
Penggunaan Isotop
Ada beberapa aplikasi Isotop.
- Radioisotop digunakan sebagai pelacak radioaktif. Isotop radioaktif memiliki sifat di mana mereka dapat dengan mudah dideteksi dan diperkirakan kuantitatif.
- Mereka juga digunakan dalam mempelajari mekanisme reaksi-reaksi yang rumit seperti fotosintesis, hidrolisis ester, dll
- Isotop radioaktif digunakan sebagai pelacak untuk mendiagnosa berbagai penyakit. Ini secara sederhana adalah istilah terkait dengan penggunaan yang sangat penting dari radioisotop. Kehadiran dan lokasi tumor otak, untuk mendeteksi sirkulasi darah, untuk memeriksa tindakan memompa darah, fungsi kelenjar tiroid, dll dapat ditemukan dengan bantuan radioisotop.
- Selain radioisotop, Isotop karbon telah digunakan dalam penanggalan karbon, fenomena untuk mendeteksi usia kayu.
- Demikian pula, isotop Hidrogen, Nitrogen dan oksigen temuan digunakan dalam sistem biologi.