– Mioglobin dan hemoglobin secara sederhana adalah istilah terkait dengan heme protein yang penting, pada prinsipnya berhubungan dengan kemampuan mereka untuk mengikat molekul oksigen.
Mioglobin secara sederhana adalah istilah terkait dengan protein heme monomer yang ditemukan terutama dalam jaringan otot di mana ia berfungsi sebagai tempat penyimpanan intraseluler untuk oksigen.
Selama periode kekurangan oksigen oxymyoglobin melepaskan oksigen terikat nya yang kemudian digunakan untuk tujuan metabolik.
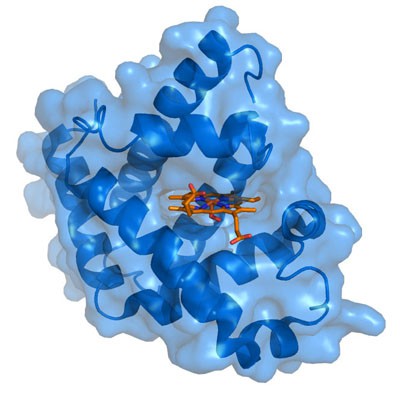
Struktur mioglobin dengan Heme
Setiap molekul mioglobin berisi satu heme kelompok prostetik yang dimasukkan ke dalam celah hidrofobik protein tersebut. Setiap residu heme mengandung satu atom besi terkoordinasi terikat sentral yang biasanya di Fe2+, atau besi, tingkat oksidasi.
Oksigen dibawa oleh heme proteins terikat langsung pada atom besi dari kelompok prostetik heme. Oksidasi besi ke Fe3+, besi, oksidasi membuat molekul mampu mengikat oksigen yang normal. Interaksi hidrofobik antara cincin tetrapyrrole dan kelompok R asam amino hidrofobik pada interior sumbing di protein sangat menstabilkan konjugasi protein heme.
Selain atom nitrogen dari kelompok histidin R terletak di atas bidang cincin heme dikoordinasikan dengan atom besi lebih menstabilkan interaksi antara heme dan protein. Dalam oxymyoglobin situs ikatan yang tersisa pada atom besi (6 koordinat posisi) ditempati oleh oksigen, yang mengikat distabilkan oleh residu histidin.
Karbon monoksida juga mengikat secara terkoordinasi untuk atom besi heme dengan cara yang sama dengan oksigen, tetapi mengikat karbon monoksida heme jauh lebih kuat daripada oksigen. preferensial mengikat karbon monoksida besi heme sebagian besar bertanggung jawab untuk sesak napas yang dihasilkan dari keracunan karbon monoksida.
Hemoglobin dewasa secara sederhana adalah istilah terkait dengan [α (2): β (2)] hemeprotein tetrameric ditemukan dalam eritrosit dimana ia bertanggung jawab untuk mengikat oksigen dalam paru-paru dan mengangkut oksigen terikat ke seluruh tubuh di mana ia digunakan dalam jalur metabolisme aerobik.
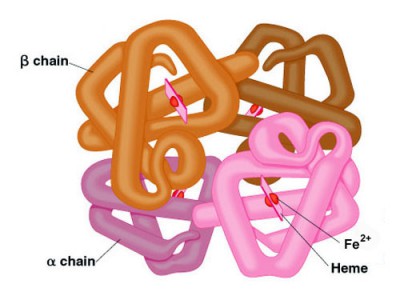
Struktur Hemoglobin
Untuk penjelasan dari berbagai jenis tetramers hemoglobin lihat bagian bawah pada Gen Hemoglobin. Setiap subunit dari tetramer hemoglobin memiliki heme kelompok prostetik identik dengan yang dijelaskan untuk mioglobin. Subunit peptida umum yang ditunjuk α, β, γ dan δ yang disusun ke dalam hemoglobin fungsional yang paling sering terjadi.
Meskipun struktur sekunder dan tersier berbagai subunit hemoglobin sama, yaitu mencerminkan homologi luas dalam komposisi asam amino, variasi dalam komposisi asam amino yang ada ditandai dengan perbedaan hemoglobin yang membawa oksigen properti. Selain itu, struktur kuartener hemoglobin menyebabkan interaksi alosterik fisiologis penting antara subunit, properti kurang mioglobin monomer yang sebaliknya sangat mirip dengan α-subunit hemoglobin.
Perbandingan sifat oksigen mioglobin dan hemoglobin yang mengikat menggambarkan sifat alosterik hemoglobin yang dihasilkan dari struktur kuaterner dan membedakan sifat hemoglobin yang mengikat oksigen dari mioglobin. Kurva oksigen mengikat hemoglobin secara sederhana adalah istilah terkait dengan sigmoidal umum protein alosterik yang substrat, dalam hal ini oksigen, secara sederhana adalah istilah terkait dengan efektor homotropic positif.
Ketika oksigen berikatan dengan subunit pertama deoxyhemoglobin meningkatkan afinitas subunit tersisa untuk oksigen. Oksigen tambahan terikat pada kedua dan ketiga subunit oksigen mengikat lebih lanjut, secara bertahap, diperkuat, sehingga meningkatkan pada tekanan oksigen di alveoli paru-paru, hemoglobin sepenuhnya jenuh dengan oksigen.
Oksihemoglobin beredar pada jaringan terdeoksigenasi, oksigen secara bertahap diturunkan dan afinitas hemoglobin terhadap oksigen berkurang. Dengan demikian pada ketegangan oksigen terendah ditemukan dalam jaringan yang sangat aktif afinitas pengikatan hemoglobin untuk oksigen sangat rendah memungkinkan pengiriman maksimal oksigen ke jaringan. Sebaliknya oksigen mengikat kurva untuk mioglobin secara sederhana adalah istilah terkait dengan hiperbolik dalam karakter menunjukkan tidak adanya interaksi alosterik dalam proses ini.