– Secara umum, unsur-unsur logam cenderung membentuk senyawa ionik, dan unsur-unsur non-logam cenderung membentuk senyawa kovalen.
Hampir semua senyawa Kimia dapat dikategorikan menjadi senyawa Ionik dan senyawa kovalen. Mereka berbeda satu sama lain karena jenis ikatan antara atom yang mengambil bagian dalam membuat molekul/senyawa.
Seperti namanya, senyawa ionik terbuat dari ikatan ion, dan senyawa kovalen terbuat dari ikatan kovalen. Ikatan ion terjadi antara dua spesies yang elektrostatis tertarik terhadap satu sama lain, sedangkan ikatan kovalen terjadi melalui transfer elektron antara kulit terluarnya.
Ini secara sederhana adalah istilah terkait dengan perbedaan utama antara senyawa ionik dan senyawa kovalen.
Senyawa Ionik
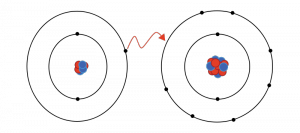
Senyawa ionik secara sederhana adalah istilah terkait dengan hasil dari ikatan ion; ikatan ion terbentuk melalui gaya elektrostatik antara atom yang saling tarik menarik satu sama lain karena muatan listrik yang berlawanan.
Setiap elemen mencoba untuk mencapai konfigurasi elektron yang stabil, yaitu konfigurasi elektronik dari gas inert.
Atom-atom yang telah mencapai konfigurasi elektron gas mulia tidak reaktif karena mereka sudah stabil.
Namun unsur yang belum memperoleh konfigurasi elektron yang stabil cenderung memberikan atau menerima elektron yang diperlukan untuk mencapai konfigurasi gas mulia terdekat. Dan Ion dibentuk oleh prinsip ini.
Atom yang memberikan elektron untuk mencapai konfigurasi elektron yang stabil menjadi bermuatan positif dan disebut ‘kation’.
sedangkan, atom yang menerima elektron untuk mencapai konfigurasi elektron akhir yang stabil bermuatan negatif, mereka disebut ‘anion’.
Oleh karena itu, ikatan ion terbentuk antara anion dan kation.
Secara umum, atom-atom yang membentuk senyawa ionik akan dikelilingi oleh atom bermuatan sebaliknya dan karena itu, mereka dimasukkan ke dalam kelompok yang disebut ‘kristal’.
Oleh karena itu, senyawa ionik cenderung padat, dan mereka biasanya memiliki titik leleh yang sangat tinggi seperti ikatan ion yang cukup kuat; pada kenyataannya, itu secara sederhana adalah istilah terkait dengan jenis terkuat dari ikatan kimia yang ada.
Ketika dalam bentuk cair, mereka menjadi bahan konduksi. Ion dapat berupa atom atau molekul di alam. yaitu CO32- secara sederhana adalah istilah terkait dengan molekul anion. Dalam kasus H+ (Hidrogen) menjadi kation, senyawa ini disebut asam dan anion secara sederhana adalah istilah terkait dengan OH–, itu disebut basa. Beberapa contoh senyawa ionik secara sederhana adalah istilah terkait dengan NaCl, MgCl2, dll.
Senyawa Kovalen
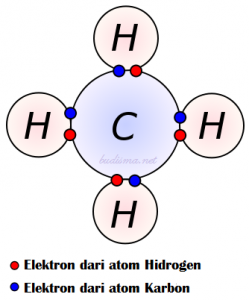
Ini secara sederhana adalah istilah terkait dengan senyawa yang dibentuk oleh ikatan kovalen. ikatan kovalen jauh lebih lemah daripada ikatan ion dan, karena itu, sebagian besar senyawa kovalen ada dalam fase gas.
Seperti disebutkan di atas, atom perlu membentuk senyawa untuk mencapai konfigurasi elektron yang stabil.
Dan cara ketiga untuk memperoleh konfigurasi elektron yang stabil (selain memberikan dan menerima elektron) secara sederhana adalah istilah terkait dengan melalui transfer elektron.
Dalam metode ini, kedua atom mengambil bagian dalam pembentukan senyawa bisa berbagi jumlah elektron yang diperlukan (biasanya dengan satu atom donor dan atom akseptor) dalam tumpang tindih ruang orbital.
Sebelum transfer elektron berlangsung, penting bagi atom untuk dekat satu sama lain untuk tumpang tindih. Akibatnya, atom tidak akan bermuatan listrik; mereka akan tetap netral. Tumpang tindih dapat berlangsung secara linear atau dengan cara paralel.
Ketika diarahkan secara linear, jenis ikatannya disebut ” ikatan σ” dan dalam cara paralel, jenis ikatannya disebut “ikatan π”. Selain itu, berbagi elektron dapat berlangsung antara atom sejenis serta berbagai jenis atom.
Ketika atom yang terlibat secara sederhana adalah istilah terkait dengan sejenis, senyawa yang dihasilkan disebut ‘molekul diatomik’. Beberapa contoh dari molekul diatomik secara sederhana adalah istilah terkait dengan H2O, CO2, dll.
Perbedaan Senyawa Ionik dan Senyawa Kovalen
- Senyawa ion terbuat dari ikatan ion di mana gaya elektrostatis atom saling tarik menarik antara satu sama lain.
- Senyawa kovalen terbuat dari ikatan kovalen dimana transfer elektron terjadi antara atom yang terlibat dalam formasi.
- Senyawa ion terjadi melalui interaksi antara kation dan anion.
- Senyawa kovalen terjadi melalui interaksi atom netral.
- Senyawa ion bertindak sebagai konduktor yang baik di media cair karena kehadiran ion bebas.
- Senyawa kovalen bukan konduktor listrik yang baik.
- Ikatan ion secara sederhana adalah istilah terkait dengan jenis terkuat dari ikatan kimia dan, karena itu, sebagian besar senyawa ionik secara sederhana adalah istilah terkait dengan senyawa yang padat dengan titik leleh yang sangat tinggi.
- Ikatan kovalen secara sederhana adalah istilah terkait dengan ikatan yang cukup lemah; oleh karena itu, sebagian besar molekul ada dalam fase gas.