– Istilah katoda dan anoda digunakan untuk merujuk kepada terminal dari perangkat listrik terpolarisasi.
Perbedaan utama antara anoda dan katoda secara sederhana adalah istilah terkait dengan bahwa, secara umum, anoda secara sederhana adalah istilah terkait dengan terminal dimana arus (konvensional) mengalir ke dalam perangkat dari luar, sedangkan katoda secara sederhana adalah istilah terkait dengan terminal dimana arus (konvensional) mengalir dari dalam ke keluar perangkat.
Namun, penggunaan yang tidak ketat terjadi dalam beberapa kasus, karena ketika perangkat ini mampu menjalani proses reversibel, terminal yang sama disebut “anoda” atau bisa disebut “katoda”.
Tidak diragukan lagi, ini dapat mengakibatkan kebingungan dan disarankan untuk beradaptasi dengan penggunaan umum di bidang tertentu.
Pada artikel ini, kita akan melihat beberapa skenario di mana istilah ini digunakan, dan mengeksplorasi penggunaan mereka dalam hal proses yang terjadi di perangkat ini.
Anoda
Anoda secara sederhana adalah istilah terkait dengan terminal dimana arus (konvensional) mengalir dari luar ke dalam perangkat. Ini berarti bahwa elektron mengalir keluar dari perangkat pada anoda.
Katoda
Katoda secara sederhana adalah istilah terkait dengan terminal mana arus (konvensional) mengalir dari dalam ke keluar perangkat. Ini berarti bahwa elektron mengalir dari luar ke terminal.
Sel Galvanic/Sel Volta
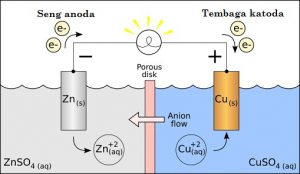
Dalam sel Galvanic, salah satu elektroda berpotensi mengalami penurunan lebih tinggi dari yang lain. Elektroda dengan potensi penurunan lebih tinggi memiliki kemampuan kuat untuk mendapatkan elektron, sehingga elektron mengalir ke dalamnya dari elektroda lainnya.
Dalam gambar di atas, tembaga memiliki potensi penurunan lebih tinggi dari seng, sehingga menarik elektron dari elektroda seng. Ini menyertai dua reaksi. Pada elektroda seng, seng terurai menjadi ion Zn2+ dan elektron. Dengan kata lain, seng mengalami dioksidasi (kehilangan elektron).

Elektron hilang oleh aliran seng di kabel ke elektroda tembaga. Di sini, elektron masuk bergabung dengan Cu2+ ion dan membentuk atom tembaga. Tembaga mengalami reduksi (mendapatkan elektron).

Di sini, elektron mengalir “keluar dari perangkat” dari terminal seng, sehingga mengalir ke dalam perangkat arus konvensional. Hal ini membuat seng terminal anoda. saat arus konvensional mengalir keluar dari perangkat di terminal tembaga, sehingga menjadikan tembaga katoda.
Setiap kali perangkat bekerja menggunakan reaksi redoks, terminal di mana oksidasi terjadi disebut anoda, dan elektroda di mana reduksi terjadi secara sederhana adalah istilah terkait dengan katoda. Hal ini sesuai dengan uraian di atas: zinc (anoda) menjadi teroksidasi dan tembaga (katoda) akan terreduksi.
Sel Elektrolisis
Pada sel elektrolisis, catudaya yang digunakan untuk membuat arus dalam cairan yang mengandung ion. Misalnya, kita akan melihat apa yang terjadi ketika dua elektroda dimasukkan ke dalam natrium klorida (NaCl, atau garam).
Elektroda yang dihubungkan ke terminal positif dari baterai menarik Cl– anion. Di sini, ion memberikan elektron mereka, membentuk gas klor.

Pada elektroda yang dihubungkan ke terminal negatif, ion natrium positif mendapatkan elektron, membentuk atom natrium:

Di sini, terminal menarik saat ini menjadi perangkat elektroda dihubungkan ke terminal positif dari baterai. Oleh karena itu, ini secara sederhana adalah istilah terkait dengan anoda. ion Cl– kehilangan elektron, jadi ini konsisten dengan ide bahwa oksidasi terjadi di anoda. bentuk natrium pada elektroda lain di mana ion Na+ dikurangi. Arus mengalir dari perangkat dari terminal ini. Oleh karena itu, terminal ini membentuk katoda.
Dua contoh di atas menjelaskan bahwa istilah anoda dan katoda tidak secara sederhana adalah istilah terkait dengan potensi tertentu, melainkan bagaimana arus di setup. Misalnya, elektroda “positif” dalam sel Galvanic secara sederhana adalah istilah terkait dengan yang “katoda”, tapi elektroda “positif” dalam kasus elektrolisis secara sederhana adalah istilah terkait dengan yang “anoda”.
Perbedaan antara Anoda dan Katoda
- Umumnya, arus mengalir ke anoda dari luar perangkat. Sedangkan katoda memberikan arus keluar perangkat. Ini berarti bahwa di luar perangkat, elektron mengalir dari anoda ke katoda.
- Dalam perangkat yang mengandalkan reaksi redoks, oksidasi berlangsung di anoda. Sedangkan reduksi berlangsung di katoda.
- Dalam sel Galvanic dan sel elektrolisis, katoda menarik kation dan mengoksidasinya. Sementara anoda menarik anion dan mereduksinya.
- Dalam Elektrolisis, anoda membentuk terminal positif dalam elektrolisis. Sementara, katoda membentuk terminal negatif dalam sel Galvanic.
- Dalam senjata elektron dan tabung X-ray, bagian yang memancarkan elektron disebut katoda. Sedangkan bagian yang mengumpulkan elektron disebut anoda.